Multiples Myelom (Knochenmarkkrebs): Symptome, Stadien, Lebenserwartung, Therapie und Neuigkeiten

Multiples Myelom (Knochenmarkkrebs)
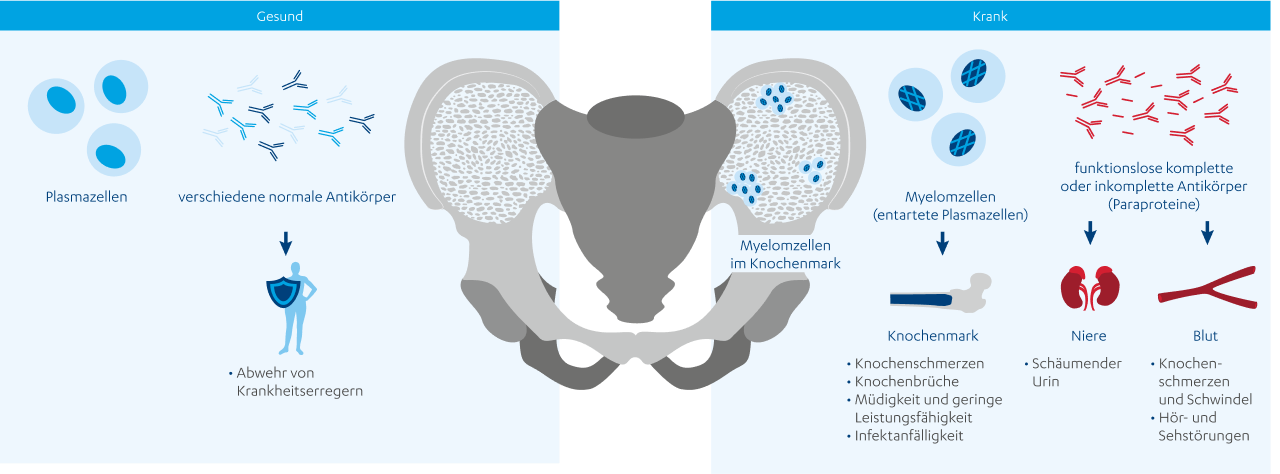
Das Multiple Myelom ist eine seltene Erkrankung, jedoch die häufigste bösartige Erkrankung des Knochenmarks. Es entsteht durch die bösartige Veränderung einer einzigen Plasmazelle, die sich im Knochenmark vielfach vermehrt, funktionsunfähige Antikörper oder Bruchstücke von Antikörpern produziert und die gesunden blutbildenden Zellen im Knochenmark verdrängt.

Multiples Myelom:
Symptome erkennen
Das Multiple Myelom verursacht meist erst nach längerer Krankheitsdauer Symptome. Lernen Sie diese kennen.

Multiples Myelom:
Behandlung und Therapie
Heute gibt es mehrere Therapiemöglichkeiten, durch die das Multiple Myelom kontrolliert werden kann. Hier erfahren Sie mehr zu den Behandlungszielen und den verschiedenen Therapien.

Multiples Myelom:
Forschung und News
Wie werden neue Medikamente geprüft? Was bedeutet die Teilnahme an einer klinischen Studie für Patient:innen? Lesen Sie mehr.
Multiples Myelom im Überblick
Das Multiple Myelom (MM) ist der häufigste Knochenmarkkrebs in den westlichen Ländern.4 Bei dieser chronischen Erkrankung des blutbildenden Systems vermehren sich veränderte Plasmazellen (Myelomzellen) vielfach (multipel) und breiten sich im Knochenmark aus.5 Sie produzieren funktionsunfähige Antikörper bzw. Bruchstücke von Antikörpern (Paraproteine)6 und verdrängen die gesunden Zellen. Beides schwächt die Immunabwehr.
Anfangs verursacht das Multiple Myelom meist kaum oder keine Symptome.1,2 Im weiteren Verlauf treten allgemeine Beschwerden wie Müdigkeit und häufige Infektionen auf, aber auch Knochenschmerzen und Knochenbrüche aufgrund einer durch das Myelom bedingten Knocheninstabilität.3
Ob und wann das Multiple Myelom eine medizinische Behandlung erfordert, hängt von einer Reihe von Faktoren ab.7 Dank verschiedener Therapiemöglichkeiten ist das Multiple Myelom heute kontrollierbar1,8 und im besten Fall bleibt über lange Zeit eine gute Lebensqualität erhalten.

In Deutschland wird ein Multiples Myelom jährlich bei ~3.600 Männern1 (55 %) und ~2.900 Frauen1 (45 %) diagnostiziert.
Wie entsteht das Multiple Myelom?

Das Multiple Myelom entsteht durch die Entartung einer Plasmazelle im Knochenmark. Plasmazellen gehören zur Gruppe der weißen Blutkörperchen und entstehen im Knochenmark. Die entartete Plasmazelle vermehrt sich unkontrolliert und führt zur Entstehung vieler Tumorherde. Die Myelomzellen produzieren im Übermaß gleichförmige (= monoklonale) Antikörper oder auch nur Bruchstücke von Antikörpern. Diese Paraproteine sind jedoch nutzlos für ihre eigentliche Aufgabe in der Immunabwehr.6
Mehr zur Entstehung erfahren
Die Ursachen für die Entstehung von Knochenmarkkrebs sind noch weitgehend unbekannt. Diskutiert werden unter anderem der Einfluss von ionisierenden Strahlen, Pestiziden, aber auch eine erbliche Komponente.1
Multiples Myelom: Symptome erkennen
Was sind die Symptome des Multiplen Myeloms?
Abgeschlagenheit, Müdigkeit und Kurzatmigkeit
- Abgeschlagenheit, Müdigkeit und Kurzatmigkeit aufgrund des verminderten Sauerstofftransports im Blut (Fehlen von roten Blutkörperchen (Erythrozyten); Anämie)
Höhere Infektanfälligkeit
- Höhere Infektanfälligkeit als Folge des beeinträchtigten Immunsystems (weniger weiße Blutkörperchen (Leukozyten))
Benommenheit, Verwirrtheit oder Herzrhythmusstörungen
- Benommenheit, Verwirrtheit oder Herzrhythmusstörungen als Folge des freigesetzten Kalziums aus den Knochen
Nierenschädigungen
- Nierenschädigungen aufgrund der vermehrten Ausscheidung von Proteinen
Durchblutungsstörungen der Organe
- Durchblutungsstörungen der Organe aufgrund der übermäßig produzierten Paraproteine
Schäumender Urin
- Schäumender Urin durch die Ausscheidung der Proteine
Erhöhte Neigung zu Blutungen
- Erhöhte Neigung zu Blutungen oder länger andauernde Blutungen als Folge des gestörten Wundverschlusses (Mangel an Blutplättchen)
Knochenschmerzen und Knochenbrüche
- Knochenschmerzen und Knochenbrüche aufgrund des Knochenabbaus
Gewichtsverlust
- Gewichtsverlust
Mehr zu den Symptomen des Multiplen Myeloms erfahren
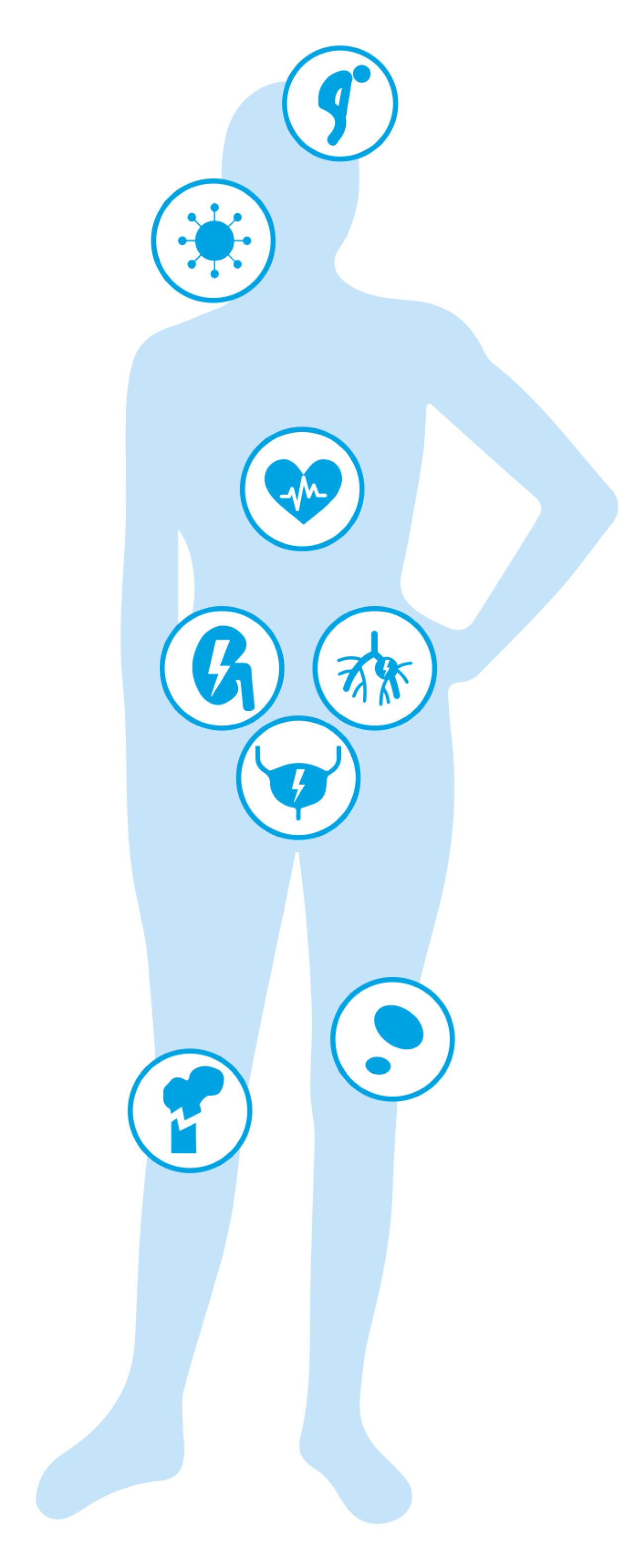
Das Multiple Myelom kann an verschiedenen Organen des Körpers Krankheitszeichen auslösen. Häufig betroffen sind insbesondere die Knochen, aber auch Nieren und Blut.3
Die Symptome des Multiplen Myeloms sind oft unspezifisch, das heißt diese können auch bei anderen Erkrankungen auftreten und bei allen Patient:innen unterschiedlich sein. Beispiele für häufig auftretende Befunde sind Knochenschmerzen, Abgeschlagenheit bzw. Fatigue, Hyperkalzämie (d. h. erhöhte Kalziumwerte im Blut), Gewichtsverlust, wiederholt auftretende Infekte oder eine eingeschränkte Nierenfunktion, welche sich beispielsweise durch schäumenden Urin äußert. Allerdings können diese Beschwerden auch bei vielen anderen Erkrankungen auftreten, also ganz andere Ursachen haben.
Das Myelom kann daher über Monate bestehen, bevor es durch eine Ärztin oder einen Arzt diagnostiziert wird. Etwa 25 % aller Patient:innen sind bei der Diagnose noch völlig beschwerdefrei.1,3 Häufig wird das Myelom bei einer Routineuntersuchung des Bluts entdeckt.
Auswirkung der Erkrankung auf den Körper
Zusammengefasst lässt sich sagen, dass die unkontrollierte Vermehrung der Myelomzellen im Knochenmark zu einer Verdrängung der gesunden blutbildenden Zellen führt. Gleichzeitig werden in großer Menge funktionslose Paraproteinen produziert und die Knochensubstanz angegriffen. Diese Prozesse sind verantwortlich für die verschiedenen Symptome des Multiplen Myeloms. Im Folgenden werden wir näher auf die einzelnen Prozesse eingehen und erläutern, welche konkreten Symptome dadurch erklärt werden können.
Den Prozess im Detail ansehen
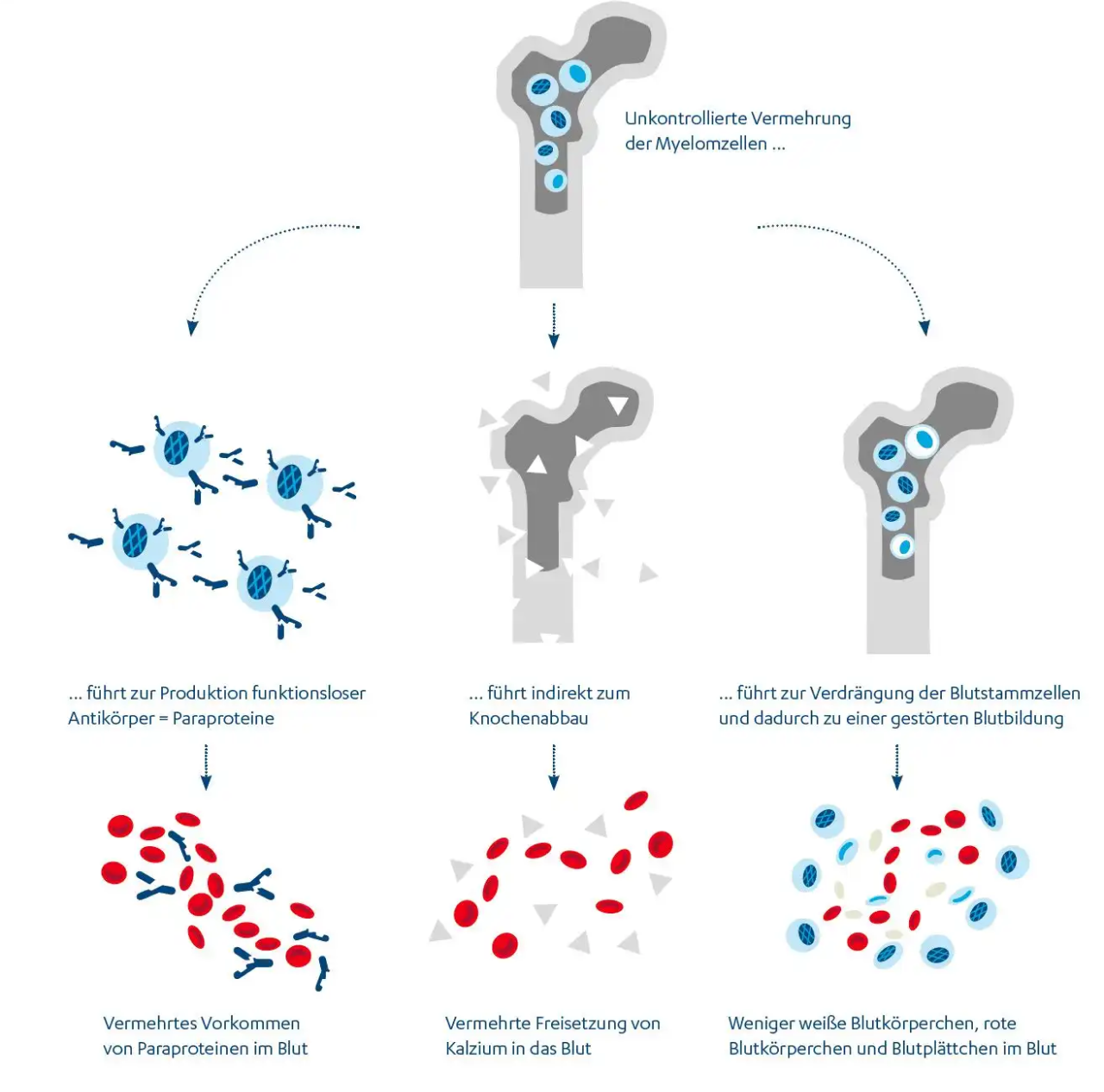
Die Symptome des Multiplen Myeloms lassen sich durch drei verschiedene Prozesse erklären, die durch die unkontrollierte Vermehrung der Myelomzellen ausgelöst werden:
1. Die Myelomzellen produzieren vermehrt funktionslose Antikörper. Diese Antikörper, auch Paraproteine genannt, sind nicht in der Lage, ihre normalen Funktionen zu erfüllen. Stattdessen sammeln sich die Paraproteine im Blut an und der Körper versucht sie über die Niere wieder auszuscheiden. Das kann die Nierenfunktion beeinträchtigen.12
2. Außerdem führt die unkontrollierte Vermehrung der Myelomzellen indirekt zum Abbau von Knochensubstanz. Die Myelomzellen setzen bestimmte Substanzen frei, die den Knochenabbau anregen. Dadurch kommt es zu einer Schwächung der Knochenstruktur und einer erhöhten Anfälligkeit für Knochenbrüche.11
3. Ein wichtiger Prozess ist die Verdrängung der Blutstammzellen durch die zahlreichen Myelomzellen im Knochenmark. Die Myelomzellen nehmen den Platz ein, der normalerweise den Vorläufern der gesunden blutbildenden Zellen, den Stammzellen, vorbehalten ist. Dadurch wird das Wachstum der gesunden blutbildenden Zellen gehemmt und die Blutbildung beeinträchtigt.10
Welche Rolle spielt das Blut beim Multiplen Myelom?
Unser Blut besteht aus verschiedenen Bestandteilen, die alle eine wichtige Funktion im Körper erfüllen. Die richtige Zusammensetzung des Blutes ist eine wichtige Voraussetzung für das Wohlbefinden und die Gesundheit eines Menschen. Beim Multiplen Myelom ist die Zusammensetzung dieser Blutbestandteile gestört.
Unser Blut besteht etwa jeweils zur Hälfte aus:
- Blutplasma, dem flüssigen Anteil des Blutes und
- Blutzellen, den festen Bestandteilen des Blutes
Es gibt drei Arten von Blutzellen:
- die roten Blutkörperchen (Erythrozyten), wichtig für den Transport des Sauerstoffs im Blut,
- die weißen Blutkörperchen (Leukozyten), wesentliche Bestandteile des Immunsystems und verantwortlich für die Abwehr von Krankheitserregern, und
- die Blutplättchen (Thrombozyten), durch die sich Wunden nach Verletzungen verschließen und heilen.
Unser Blut besteht aus verschiedenen Bestandteilen, die alle eine wichtige Funktion im Körper erfüllen. Die richtige Zusammensetzung des Blutes ist eine wichtige Voraussetzung für das Wohlbefinden und die Gesundheit eines Menschen. Beim Multiplen Myelom ist die Zusammensetzung dieser Blutbestandteile gestört.
Die gesteigerte und fast unbegrenzte Vermehrung der erkrankten Plasmazellen im Knochenmark ist ein wesentliches Merkmal des Multiplen Myeloms. Da die entarteten Plasmazellen Platz brauchen, können die im Knochenmark befindlichen Vorläufer der gesunden blutbildenden Zellen verdrängt werden.10 Das Wachstum der gesunden blutbildenden Zellen (roten Blutkörperchen, Blutplättchen und weißen Blutkörperchen) im Knochenmark wird gehemmt. Das Ausmaß der Beschwerden aufgrund der Blutbildveränderung hängt von der Menge der entarteten Plasmazellen ab.
- Die Reifung der roten Blutkörperchen wird beeinträchtigt. Durch den Mangel an roten Blutkörperchen (Anämie) kommt es zu Beeinträchtigungen im Sauerstofftransport, was sich bei Betroffenen durch verstärkte Müdigkeit (Fatigue), Blässe, Schwäche, Abgeschlagenheit, Kopfschmerzen und Luftnot, besonders bei körperlicher Belastung, bemerkbar machen kann.
- Im weiteren Krankheitsverlauf kann es zu einem Mangel an weißen Blutkörperchen (Leukopenie) kommen. Dies kann mit einer gesteigerten Anfälligkeit für Infekte verbunden sein. Etwa 10–20 % der Patient: innen leiden unter wiederholt auftretenden, überwiegend bakteriellen Infekten. Diese können beispielsweise die oberen Atemwege betreffen.1,13
- Der Mangel an Blutplättchen macht sich durch einen schlechteren Wundverschluss bemerkbar: Es dauert länger, bis eine Wunde aufhört zu bluten. Zudem kann es durch den Mangel vorkommen, dass selbst ohne Verletzungen blaue Flecken entstehen.
Welchen Einfluss hat das Multiple Myelom auf die Knochen?
Durch Anregung der knochenabbauenden Zellen (Osteoklasten) und Hemmung der knochenaufbauenden Zellen (Osteoblasten) beeinflussen die Myelomzellen den normalen Knochenstoffwechsel. Dies kann zu Verlust an Knochensubstanz (Knochenauflösungen), Knochenbrüchen und Schmerzen führen.11 Man spricht hier von porösen Knochen. Die Knochenschmerzen beginnen oft schleichend und nehmen mit der Zeit zu. Häufig stehen Rückenschmerzen im Bereich der Brust- und Lendenwirbelsäule im Vordergrund. Durch das Zusammensinken von Wirbelkörpern lässt sich häufig ein Körpergrößenverlust von mehreren Zentimetern feststellen.6
Außerdem gelangt infolge der Auflösung des Knochengewebes vermehrt Kalzium in den Blutkreislauf. Eine Erhöhung der Blutkalziumwerte, die Hyperkalzämie genannt wird, kann zu zahlreichen weiteren Komplikationen führen. Beispielsweise bedingt eine vermehrte Kalziumausscheidung im Urin, dass vermehrt Harn ausgeschieden wird. Der Körper verliert somit Flüssigkeit. Der hohe Kalziumgehalt kann auch zu Übelkeit und Erbrechen führen, wodurch noch mehr Flüssigkeit verloren gehen kann.
Welche Bedeutung haben funktionslose Antikörper für die Symptome von Knochenmarkkrebs?
Die Myelomzellen produzieren eine große Menge funktionsloser Antikörper – sogenannte Paraproteine. Dadurch kann der Eiweiß-/Proteingehalt des Blutes erheblich ansteigen. Durch die überdurchschnittliche Menge an Paraproteinen im Blut kann das Blut dickflüssiger (visköser) werden. Die Folge können Durchblutungsstörungen, aber auch Seh- und Gedächtnisstörungen, Schwindel und Enge in der Brust sein.
Da ein Teil der Proteine über die Nieren ausgeschieden wird, können die Proteine die Nierenkanälchen verstopfen und so die Nierenfunktion beeinträchtigen. Dies kann bei Erstdiagnose ca. 20–40 % der Patient:innen betreffen, im weiteren Verlauf der Erkrankung können > 50 % der Patient:innen betroffen sein.5 Dies tritt durch das Ausscheiden der funktionslosen Antikörper oder deren Bruchstücke auf.
Wie wird die Diagnose des Multiplen Myeloms gestellt?
Um den Verdacht auf ein Multiples Myelom zu bestätigen, müssen umfangreiche Untersuchungen durchgeführt werden.
Eine möglichst genaue Diagnostik ist wichtig, um:
- das Stadium der Erkrankung zu bestimmen,
- den Krankheitsverlauf (Prognose) besser einschätzen zu können,
- die Therapieentscheidung (Art der Behandlung) zu treffen und
- den Therapieerfolg durch vergleichende Untersuchungen im Verlauf zu kontrollieren.
Die Diagnostik basiert insbesondere auf folgenden Säulen:

Bevor die Ärztin oder der Arzt Ihren Körper untersucht, fragt er Sie gezielt nach Ihren Beschwerden, zum Beispiel, ob Sie unter Knochenschmerzen, Fatigue, Müdigkeit, Gewichtsverlust, schäumendem Urin, Blutungen oder Infektionen leiden.
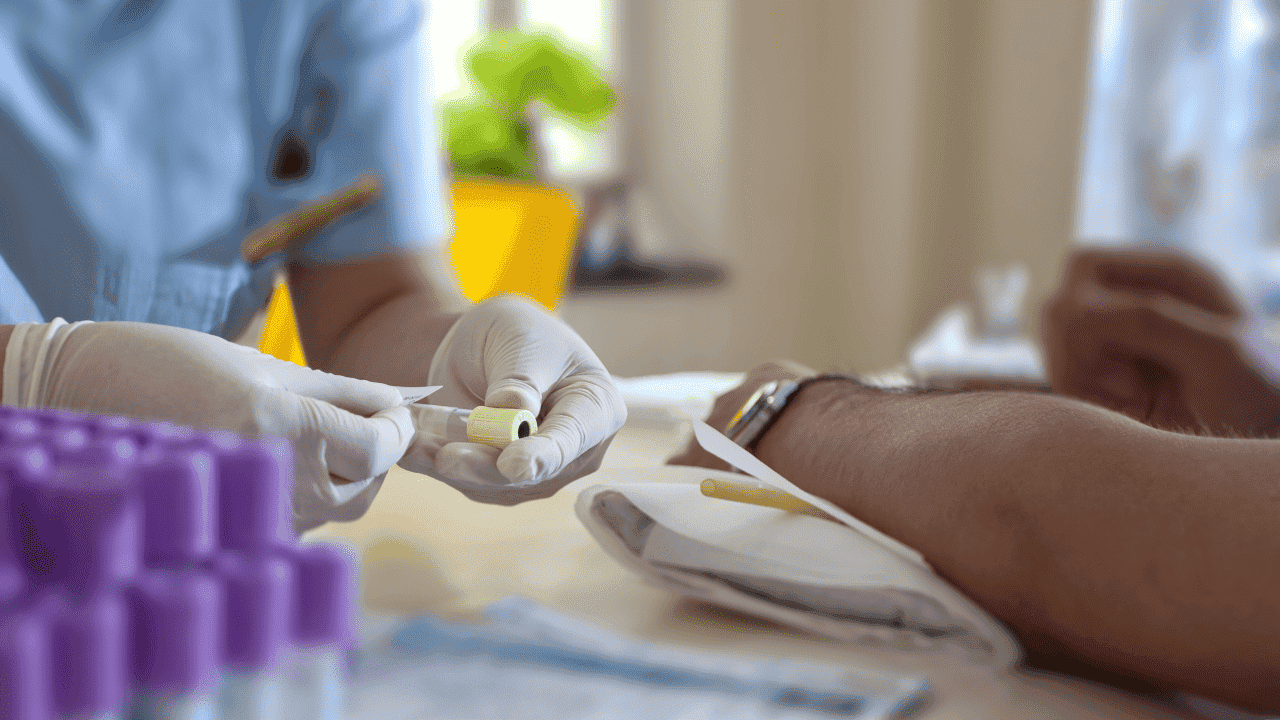
Zur Labordiagnostik zählt insbesondere die Untersuchung des Bluts und des Urins.

Die bildgebenden (d. h. optisch sichtbar darstellenden) Verfahren tragen ganz wesentlich dazu bei, Veränderungen im Knochen zu erkennen und zu protokollieren. Sie zeigen den generellen Schwund der Knochendichte oder zum Beispiel inwieweit die Knochen, etwa durch eine Osteolyse (Knochenschäden), in Mitleidenschaft gezogen worden sind.
Blutbild und Labordiagnostik

Anhand des Blutbilds können die Ärzt:innen dann zum Beispiel feststellen, welche Zellen vermehrt und welche vermindert sind. Sie sehen zudem unter dem Mikroskop, ob die Zellen verändert sind. Besonders wichtig ist die Bestimmung des M-Gradienten durch eine Serumeiweiß-Elektrophorese. Der M-Gradient steigt bei Zunahme monoklonaler Antikörper im Blut deutlich an und ist ein wichtiger Marker beim Multiplen Myelom.12 Je nachdem, welche Paraproteine vermehrt sind, wird die Erkrankung unterschiedlich eingeteilt. Liegen zum Beispiel besonders viele Paraproteine der Antikörperklasse IgG vor, spricht man von einem IgG-Myelom. Besonders häufig sind IgG- und IgA-Myelome. Sie machen etwa 80 % der Erkrankungen aus.1
Wichtige Werte des Blutbildes
Elektrolyte wie Natrium, Kalium und Kalzium (Kalziumfreisetzung aus den Knochen)
Nierenwerte wie Kreatinin, glomeruläre Filtrationsrate (GFR), Harnstoff
Alanin-Aminotransferase (Hinweise auf Leberbeteiligung)
Laktatdehydrogenase (wird beim Absterben von Zellen freigesetzt)
Gesamteiweiß und Albumin im Serum (vermehrte Antikörperbildung)
Beta-2-Mikroglobulin (Zeichen der Tumorlast, verstärktes Wachstum von Myelomzellen)
Immunglobuline (Antikörper) im Serum, quantitativ
freie Leichtketten (Antikörperbestandteile) im Serum, quantitativ
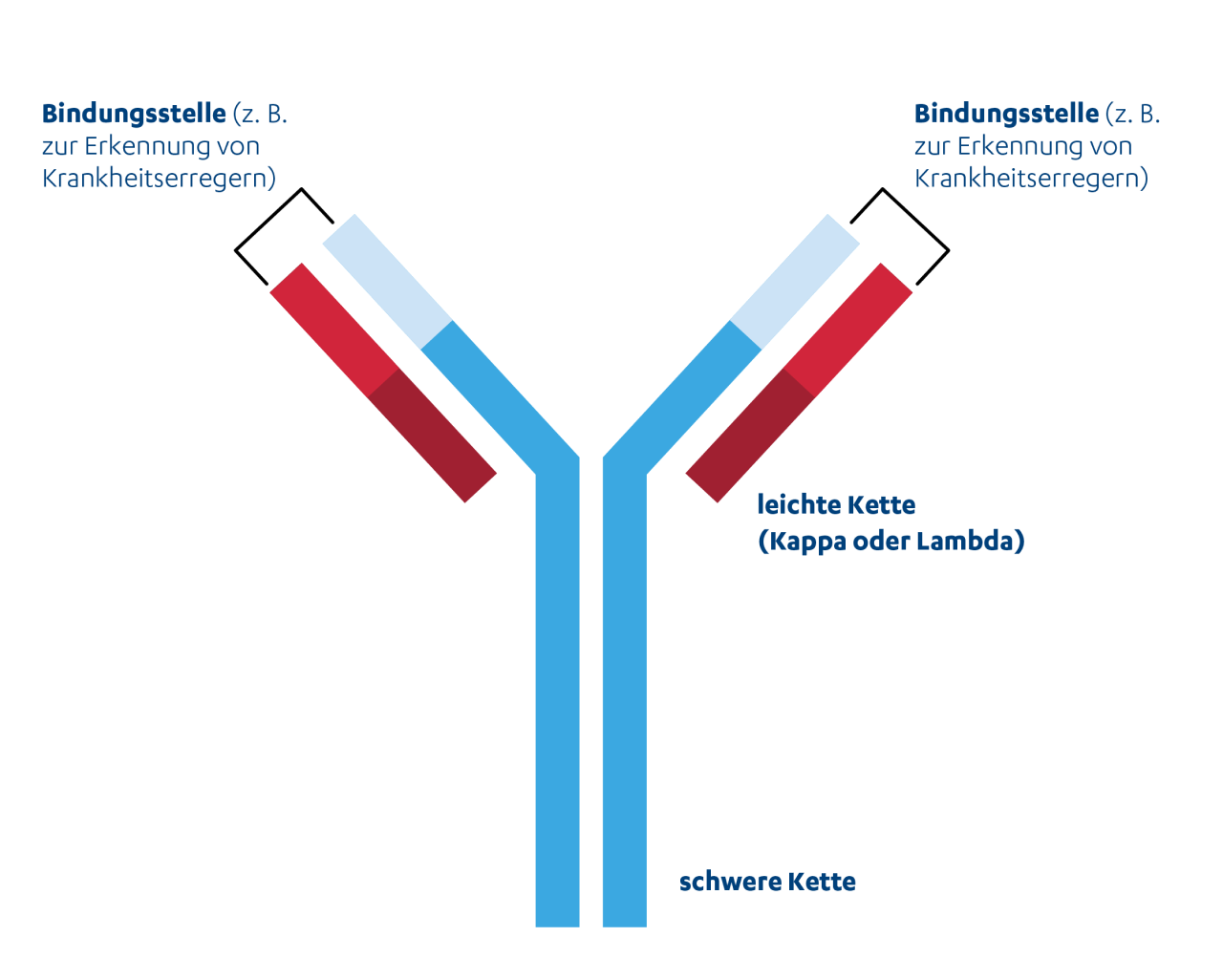
Der Freie-Leichtketten-Test (FLC-Test)14
Es gibt zwei Typen von freien Leichtketten: Kappa und Lambda. Zusammen mit schweren Ketten bilden diese Antikörper (Immunglobuline). Bei einer Myelom-Erkrankung ist zumeist ein Typ der Leichtketten vermehrt und somit das Verhältnis der beiden Typen verschoben (Kappa/Lambda-Ratio). Der Test spielt eine Rolle bei der Diagnosestellung, aber auch um zu beurteilen, ob die Therapiemaßnahmen wirken. Darüber hinaus gibt es auch den Schwerketten-Test.
Untersuchungen im Urin
Im Urin kann die Proteinausscheidung bestimmt werden. Dafür wird über 24 Stunden der gesamte Urin gesammelt und anschließend untersucht. Zum einen dient das der Überprüfung der Nierenfunktion, denn eine gesunde Niere scheidet in der Regel nur geringe Konzentrationen des Proteins Albumin aus. Zum anderen kann man ähnlich wie im Blut auch im Urin Antikörperbestandteile nachweisen.
Aufbau eines Antikörpers
Bildgebende Verfahren

Zu den bildgebenden Verfahren zählen die konventionelle Röntgenuntersuchung, Low-Dose-Computertomografie (CT), Kernspintomografie/Magnetresonanztomografie (MRT) und in bestimmten Fällen die PET-CT (Kombination aus Positronen-Emissions-Tomografie und Computertomografie).
Computertomografie (CT)
Bei einer Computertomografie (CT) handelt es sich um ein spezielles bildgebendes Röntgenverfahren, bei dem der untersuchte Körperabschnitt in vielen Schnittbildern dargestellt wird. Die Untersuchung ist für den Betroffenen schmerzfrei und für die Durchführung wird kein Kontrastmittel benötigt. Die Ganzkörper-Low-Dose-Computertomografie, wie sie beim Myelom angewandt wird, hat eine relativ geringe Strahlenbelastung und stellt besonders gut Veränderungen am Knochen dar.
Kernspintomografie oder Magnetresonanztomografie (MRT)
Die Kernspintomografie oder auch Magnetresonanztomografie (MRT) gehört zu den bildgebenden Untersuchungsverfahren. Anders als das Röntgen oder die Computertomografie kommt sie ohne Röntgenstrahlung aus. Bei der MRT werden mit einem starken Magnetfeld und durch Radiowellen detaillierte Bilder des Körperinneren erzeugt. In der Myelom-Diagnostik kann die MRT besonders früh Informationen über die Lage und die Größe eines Tumors liefern. Im Vergleich mit der CT: Bei einer MRT erreicht man im Vergleich zu einer CT eine höhere Sensitivität zum Nachweis von Myelom bedingten Skelettläsionen, muss dafür aber eine lange Untersuchungszeit in Kauf nehmen.
PET-CT
Bei der PET-CT werden radioaktive Substanzen verabreicht, die sich in Myelom-Läsionen anreichern und in einer CT sichtbar gemacht werden können. Da die PET-CT sehr zeit- und geldaufwendig ist, ist sie speziellen Fragestellungen und bestimmten Verlaufsbeobachtungen vorbehalten.
Wie werden die Stadien des Multiplen Myeloms bestimmt?
Um das Stadium der Erkrankung bestimmen zu können, nutzt die Onkologin oder der Onkologe international anerkannte Methoden, in welchen die Kriterien für die Festlegung auf das jeweilige Stadium definiert sind.
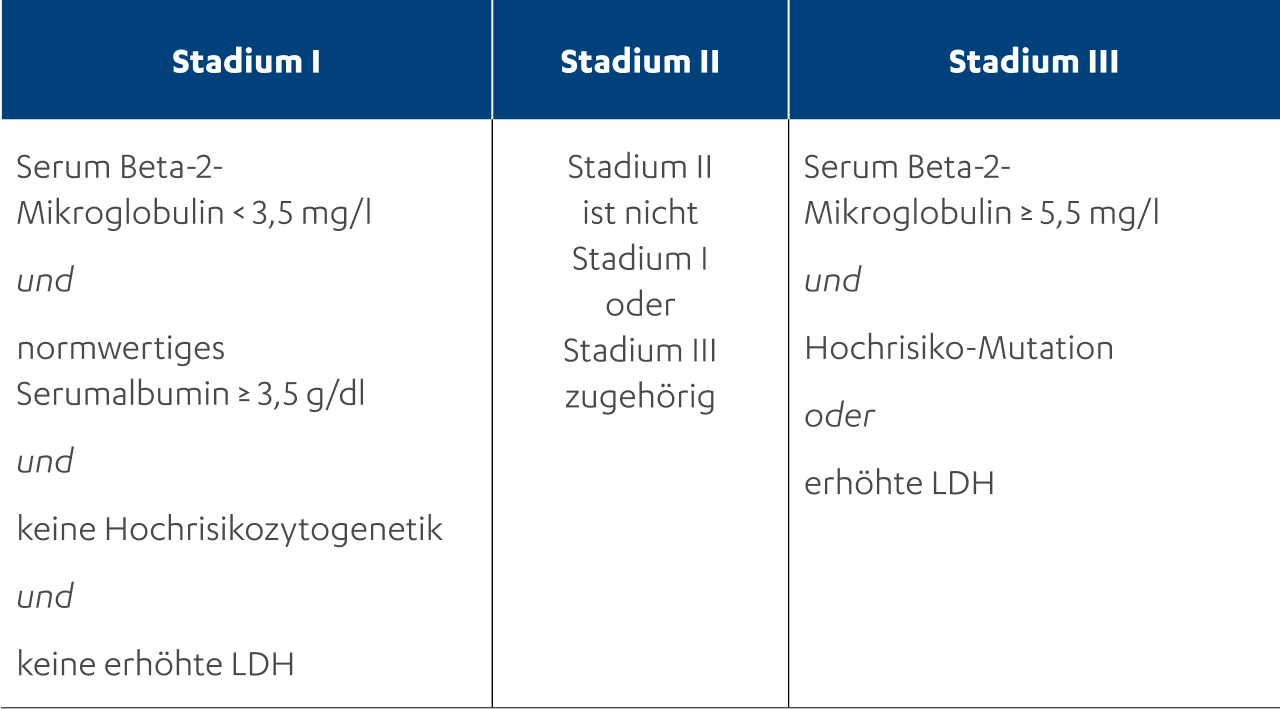
Seit 1975 wird das Multiple Myelom entsprechend der Kriterien von Salmon und Durie in drei Stadien (Stadium I bis III) eingeteilt.15 Diese Einteilung kommt immer noch zum Einsatz, seit 2005 gibt es jedoch auch eine Stadieneinteilung der International Myeloma Working Group16, das sogenannte International Staging System (kurz: ISS). Diese Einteilung wurde in der Zwischenzeit noch einmal überarbeitet und ist heute als Revised International Staging System (R-ISS) bekannt.17 Auch beim ISS und R-ISS wird das Multiple Myelom in drei Stadien eingeteilt.
Ungeachtet der Methode zur Stadieneinteilung und den einzelnen gemessenen Kriterien zeigen sich in den verschiedenen Stadien meist einige Gemeinsamkeiten. Diese sind im Folgenden grob beschrieben. Im Einzelfall kann es sich allerdings von Patient:in zu Patient:in etwas anders verhalten.

Das Auftreten von Krankheitssymptomen ist meist noch nicht spürbar. Die Patient:innen werden vorsorglich engmaschig beobachtet.

In Stadium II ist der Anstieg auffälliger Laborwerte weiter fortgeschritten, es treten bereits wahrnehmbare Symptome auf. Die Knochenstruktur zeigt vermehrt Anzeichen eines beginnenden Abbaus.

In diesem Stadium sind die bösartigen Veränderungen bereits fortgeschritten. Das Blutbild hat sich stark verändert. Im Blut und im Urin finden sich in hoher Zahl funktionslose Immunglobuline (Paraproteine). Auch der Knochenabbau ist fortgeschritten und an mehreren Stellen sichtbar.
Stadieneinteilung
Für die Stadieneinteilung werden bestimmte Werte im Blut gemessen. Außerdem spielt je nach Methode die Zytogenetik der Myelomzelle eine wichtige Rolle für die Stadieneinteilung: Weisen die Myelomzellen bestimmte genetische Veränderungen (= Mutationen) auf, so ist die Prognose ungünstiger, als wenn diese nicht vorhanden sind. Des Weiteren können bestimmte Veränderungen an den Knochen oder eine eingeschränkte Nierenfunktion in die Stadieneinteilung mit einfließen.
Zu messende Blutwerte
Beta-2-Mikroglobulin: Ein Protein, das sich auf der Oberfläche aller Zellen im menschlichen Körper befindet. Bei Gesunden ist der Wert recht konstant. Vermehren sich Zellen unkontrolliert, steigt der Wert an.
Laktatdehydrogenase (LDH): Ein Enzym, das u. a. freigesetzt wird, wenn Zellen geschädigt werden und absterben. Ein hoher LDH-Wert weist auf eine krankheitsbedingte Zellschädigung im Körper hin.
Albumin: Ein Eiweiß, das im menschlichen Körper größtenteils im Blut vorliegt. Ein erniedrigter Wert wird u. a. bei Krebserkrankungen beobachtet.
Hämoglobin: Der Farbstoff der roten Blutkörperchen. Ein verminderter Wert deutet auf eine gestörte Blutbildung im Knochenmark hin.
Kalzium: Dieser Knochenbestandteil wird freigesetzt, wenn es durch das Myelom zum Abbau von Knochen kommt, und lässt sich dann vermehrt im Blut nachweisen
Immunglobuline: Werden von Plasmazellen produziert und sind normalerweise für die Immunabwehr zuständig. Beim Multiplen Myelom werden besonders viele funktionslose, komplette oder inkomplette Immunglobuline durch die Myelomzellen gebildet.
Stadieneinteilung nach Salmon und Durie15 und R-ISS-Stadieneinteilung17
Stadieneinteilung nach Salmon und Durie15

R-ISS-Stadieneinteilung17
Welchen Einfluss haben die Symptome auf die Therapieentscheidung beim Multiplen Myelom?
Neben den drei klinischen Stadien wird in der Praxis oft noch eine andere wichtige Einteilung von Knochenmarkkrebs vorgenommen. Dabei unterscheiden Ärzt:innen zwischen einer asymptomatischen (d.h. ohne nachweisbare Symptome) (i. d. R. Stadium I) und einer symptomatischen (i. d. R. Stadium II und III) Erkrankung. Diese Unterscheidung ist vor allem für die Therapieentscheidung wichtig. In der Regel müssen Patient:innen mit einem asymptomatischen Multiplen Myelom nicht aktiv mit Medikamenten behandelt werden.
Auch die sogenannten SLiM-CRAB-Kriterien können Einfluss auf die Art und Weise der Therapie haben. Mit ihrer Hilfe können zum Beispiel asymptomatische Patienten identifiziert werden, bei denen mit hoher Wahrscheinlichkeit die Progression (Fortschreiten) zu einem symptomatischen Multiplen Myelom bevorsteht (= Hochrisikogruppe). Bei diesen Patient:innen ist eine frühzeitige Behandlung zur Vermeidung von Organschäden möglich.
Exkurs: Was sind die SLiM-CRAB-Kriterien?
Anhand von verschiedenen Laborwerten und anderen Kriterien kann beurteilt werden, inwieweit das Multiple Myelom bereits Auswirkungen auf den Körper der Patient:innen hat. Eine Orientiertung für Behandler:innen sind dabei die sogenannten CRAB-/SLiM-CRAB-Kriterien.
CRAB ist eine Abkürzung und steht für:18
| C | Hyperkalzämie (Calcium elevation = C) erhöhte Kalziumwerte im Blut |
| R | Niereninsuffizienz (Renal dysfunction = R) Nierenfunktionsstörung |
| A | Anämie (Anemia = A) Blutarmut |
| B | Knochenbeteiligung (Bone = B) Knochenschäden |
Die International Myeloma Working Group16 hat 2014 die CRAB-Kriterien aktualisiert und erweitert. Dabei sind die SLiM-Kriterien neu hinzugekommen.
SLiM-Kriterien:18
| S | Knochenmarkinfiltration (Sixty = S) prozentualer Gehalt von Plasmazellen im Knochenmark > 60 % |
| LI | freie Leichtketten (Light chain = Li) Freie-Leichtketten-Quotienten im Serum > 100 (betroffene/nicht betroffene Leichtketten) |
| M | fokale Läsionen im MRT (MRT = M) > 1 Herdbefund (Knochenschädigung) in der MRT-Bildgebung |
Ist eines oder sind gar mehrere dieser Kriterien erfüllt, dann kann das ein Hinweis darauf sein, dass eine Behandlung eingeleitet oder die Patientin / der Patient besonders engmaschig beobachtet werden sollte. Abgesehen von diesen Kriterien können folgende Symptome Ausschlag für die Entscheidung zu einer bestimmten Behandlungsmethode sein:
- myelombedingte Schmerzen
- wiederkehrende schwere Infektionen
- erhöhte Zähflüssigkeit des Blutes (Blutviskosität)
- Symptome, deren Nichtbehandlung zu einer weiteren Verschlechterung der Symptomatik bzw. Organfunktion führt
- Symptome, die durch Behandlung der Myelom-Erkrankung verbessert werden können
- Fieber, Nachtschweiß, Gewichtsverlust (sogenannte B-Symptomatik)
Die Entscheidung, mit einer medizinischen Therapie zu beginnen, ist letztlich von vielen Faktoren oder Kombinationen von bestimmten Faktoren abhängig und individuell unterschiedlich. Ihr Arzt oder Ihre Ärztin wird Sie dazu beraten.
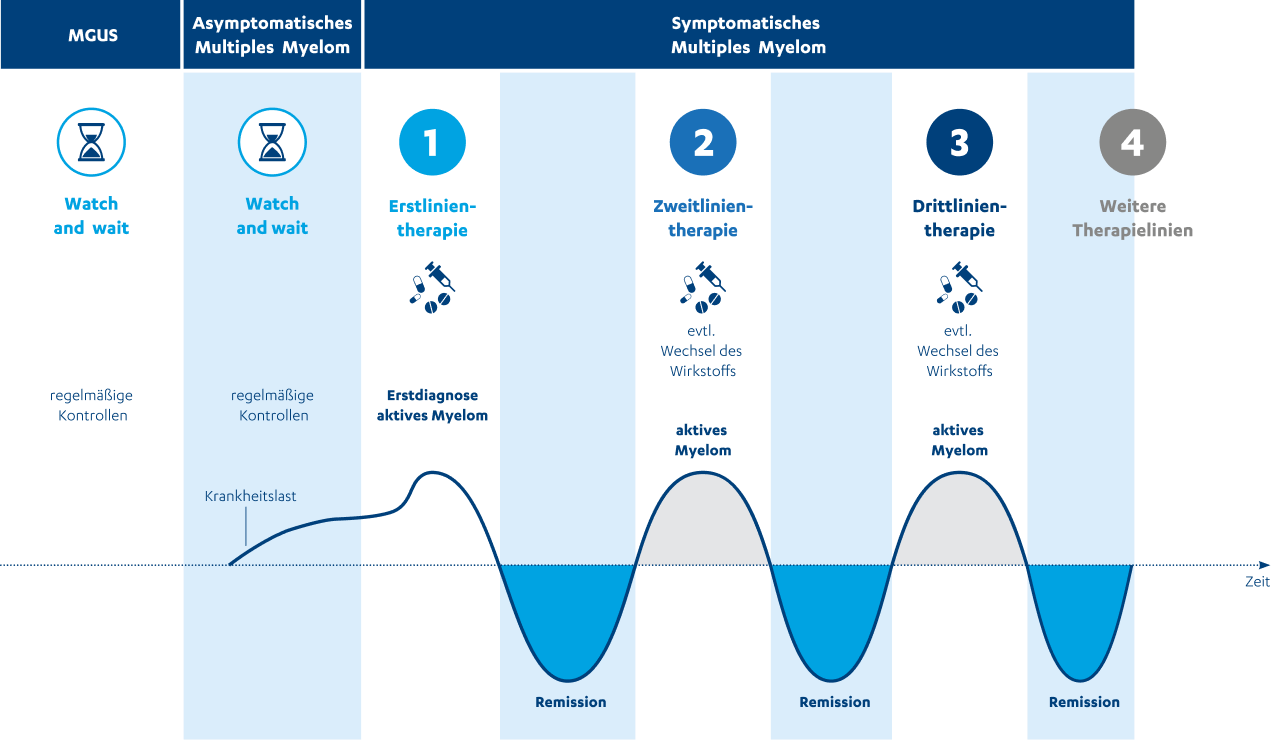
Asymptomatisches Multiples Myelom
Das asymptomatische (d.h. ohne nachweisbare Symptome) Multiple Myelom kann als eine Art Zwischenstufe zwischen der monoklonalen Gammopathie unklarer Signifikanz (MGUS)1,5 – einer Vorstufe des Multiplen Myeloms – und dem symptomatischem Multiplen Myelom angesehen werden. Mehr zur MGUS und anderen Vorstufen bzw. Sonderformen des Multiplen Myeloms erfahren Sie hier.
Beim asymptomatischen Multiplen Myelom1,5 liegen mehr Plasmazellen im Knochenmark vor als bei der MGUS, es sind jedoch auch hier noch keine Organschäden nachweisbar. Patient:innen mit asymptomatischem Knochenmarkkrebs werden engmaschig beobachtet. Dieses Vorgehen ist auch als „Watch and wait“-Strategie (abwartendes Verhalten) bekannt und etabliert. Dabei wird mit der Therapie zunächst noch abgewartet, da die Symptome und Kriterien in der gegenwärtigen Zeit noch nicht ausreichend für eine Behandlung, die ggf. mit Nebenwirkungen verbunden sein könnte sind.
Zur Kontrolle werden bei diesen Patient:innen beispielsweise die Knochen mittels bildgebender Verfahren (Röntgen oder CT, ggf. Kernspintomografie) genau untersucht. Die Nieren-, Leber- und Herzfunktion sowie die Blutbildung werden analysiert. Sobald sich der Zustand oder die Werte verschlechtern, kann mit einer Therapie begonnen werden.
Symptomatisches Multiples Myelom1,5
Als symptomatisch wird das Myelom bezeichnet, wenn die Erkrankung zu Organschäden führt oder mit Beschwerden einhergeht. Dies lässt sich zum Beispiel anhand der CRAB-Kriterien überprüfen. Ein symptomatisches Multiples Myelom wird ohne länger abzuwarten behandelt.
Vorstufen und Sonderformen
Neben dem Multiplen Myelom gibt es einige Vorstufen und Sonderformen. Die sogenannte monoklonale Gammopathie unklarer Signifikanz, kurz: MGUS1,5, sowie das Smoldering Myeloma19 (dt.: schwelendes Multiples Myelom) gehören zu den Vorstufen des Knochenmarkkrebses. Aus ihnen kann im Laufe der Zeit ein Multiples Myelom entstehen. Das Multiple Myelom wurde früher auch als Plasmozytom bezeichnet. Inzwischen ist diese Bezeichnung veraltet. So kommt es nicht mehr so leicht zu Verwechslungen mit dem solitären Plasmozytom, dass eine Sonderform des Knochenmarkkrebses bezeichnet.
Vorstufe: MGUS – monoklonale Gammopathie unklarer Signifikanz
Die monoklonale Gammopathie unklarer Signifikanz, kurz: MGUS1,5, gilt als Vorstufe des Multiplen Myeloms, sowie der verwandten Erkrankungen Morbus Waldenström und Amyloidose. Die MGUS an sich ist noch keine Erkrankung, sondern ein Laborbefund, der bedeutet, dass entartete Plasmazellen im Knochenmark vorhanden sind. Deren Anzahl ist jedoch so gering, dass keine Krankheitssymptome bestehen. Meist wird dieser Befund zufällig entdeckt und er ist als reine Laborauffälligkeit einzuordnen. Hier ist es wichtig, die Werte zu beobachten, da sich die MGUS mit einer geringen Wahrscheinlichkeit von etwa 1 % pro Jahr zu einem Multiplen Myelom entwickeln kann.11 MGUS-Patient:innen können anhand verschiedener Kriterien in Niedrig-, Intermediär- und Hochrisikogruppen eingeteilt werden. Eine gesicherte Vorstufe bedeutet “nur”, dass ein statistisch höheres Risiko für ein Fortschreiten in ein behandlungsbedürftiges Multiples Myelom oder eine andere Erkrankung vorliegt. Somit hat der Befund MGUS an sich noch keinen Krankheitswert, regelmäßige Kontrolluntersuchungen sind jedoch sehr wichtig.
Kriterien für eine MGUS:
Im Blutbild werden monoklonale Antikörper (auch Immunglobuline genannt) und/oder deren Bestandteile nachgewiesen, ohne dass der Patient oder die Patientin klinische Symptome (Beschwerden) hat. Diese Immunglobuline werden auch als monoklonales Protein (M-Protein oder M-Gradient) oder Paraproteine bezeichnet. Weiterhin liegt der Befall des Knochenmarks (Knochenmarkinfiltration) durch Plasmazellen bei < 10 %.11
Kriterien auf einen Blick:20
- monoklonales Protein im Serum < 30 g/l und
- prozentualer Anteil der monoklonalen Plasmazellen im Knochenmark < 10 % und
- keine Organschädigung nach CRAB-Kriterien nachweisbar
Vorstufe: Smoldering Myeloma
Das Smoldering Myeloma ist ebenfalls eine Vorstufe des Multiplen Myeloms. Es unterscheidet sich von der MGUS darin, dass der Anteil der Myelomzellen im Knochenmark und der Anteil an Paraproteinen im Blut höher ist. Somit besteht hier auch ein höheres Risiko, dass die Vorstufe in ein Multiples Myelom übergeht: Je nach Risikokategorie liegt die Wahrscheinlichkeit dafür bei 25 bis 75 % innerhalb von fünf Jahren nach Diagnose.21 Dementsprechend wird ein Smoldering Myeloma engmaschig kontrolliert, um bei Bedarf frühzeitig eine Therapie einzuleiten.
Sonderform: Solitäres Plasmozytom
Eine Sonderform des Multiplen Myeloms ist das solitäre (einzeln vorliegende) Plasmozytom. Es wird unterschieden zwischen solitären ossären (in einem Knochen befindlichen) Plasmozytomen und extraossären, extramedullären (außerhalb des Knochenmarks liegenden) Plasmozytomen. Therapie der Wahl ist die lokale Bestrahlung, allerdings entwickeln bis zu 50 % der Patienten im weiteren Verlauf ein Multiples Myelom.1
Wie ist die Prognose beim Knochenmarkkrebs?
Wie ist die Lebenserwartung beim Multiplen Myelom?
Der Knochenmarkkrebs ist eine sehr heterogene Erkrankung, d.h. sie ist bei allen Patient:innen unterschiedlich ausgeprägt. Die medizinische Vorhersage des Krankheitsverlaufs, auch Prognose genannt, beruht daher auf vielen verschiedenen Faktoren. Ihr allgemeiner Gesundheitszustand beeinflusst die Prognose genauso wie Ihr biologisches Alter, das Stadium des Multiplen Myeloms und eventuell weitere vorliegende Erkrankungen. Das Krankheitsstadium kann somit nur einen Hinweis auf die Prognose geben. So liegt die 5-Jahres-Überlebensrate im Stadium I nach ISS bei ca. 80 %, im Stadium II bei ca. 60 % und im Stadium III bei 40 %.1 Diesen Zahlen stellen lediglich Durchschnittswerte dar und können im individuellen Fall abweichen.
Ist das Multiple Myelom heilbar?
Nach heutigem Stand kann Knochenmarkkrebs leider von keiner der verfügbaren Therapien vollständig geheilt werden. Der Verlauf dieser Krebserkrankung kann von Patient:in zu Patient:in sehr unterschiedlich sein und lässt sich daher schwer vorhersagen. Dennoch ist es heutzutage in einigen Fällen möglich, lange Remissionszeiten von bis zu zehn Jahren oder mehr zu erreichen.22 Eine sogenannte Remission ist eine überwiegend beschwerdefreie Phase, in der die Erkrankung gut unter Kontrolle gehalten werden kann und nicht weiter fortschreitet.

Die Prognose ist in den letzten Jahren durch die wissenschaftliche Forschung kontinuierlich besser geworden.

Die Erkrankung selbst gilt zwar als nicht heilbar, ...

... durch die Therapie können aber beschwerdefreie Phasen erreicht werden und das Fortschreiten der Erkrankung verlangsamt werden.
Multiples Myelom: Behandlung und Therapie
Was ist wichtig bei der Behandlung des Multiplen Myeloms?
Grundsätzlich gilt: Die Diagnose Multiples Myelom muss nicht automatisch bedeuten, dass direkt eine medizinische Behandlung erforderlich ist. Entscheidend ist, inwieweit das Multiple Myelom bereits Auswirkungen auf Ihren Körper hat. Dies kann anhand von verschiedenen Laborwerten und anderen Kriterien beurteilt werden. Im Behandlungsschema ist neben der aktiven medizinischen Therapie die sogenannte „Watch and wait“-Strategie (abwartendes Verhalten) etabliert.1 Hier werden die Patient:innen bei engmaschigen Kontrolluntersuchungen beobachtet und es wird mit der Therapie noch abgewartet, da die Symptome und Kriterien in der gegenwärtigen Zeit noch nicht ausreichend für eine Behandlung, die ggf. mit Nebenwirkungen verbunden sein könnte, sind. Sobald sich der Zustand oder die Werte verschlechtern, kann mit einer Therapie begonnen werden.
Was ist wichtig bei der Behandlung des Multiplen Myeloms?
Aufgrund der intensiven Erforschung von Behandlungsalternativen eines Multiplen Myeloms können Patient:innen heutzutage eine viel längere Lebenszeit als noch vor einigen Jahren erreichen. Auch die Lebensqualität hat sich durch die weiterentwickelten und neuen Therapien erheblich verbessert. Mit den Erkenntnissen, die aus der Forschung zur Verfügung stehen, gibt es eine große Anzahl an Kombinationstherapien, die individuell über mehrere Therapielinien einsetzbar sind.
Welche Therapie am besten geeignet ist und wann diese begonnen werden sollte, hängt von unterschiedlichen Faktoren ab. Um eine geeignete Therapie zu finden, wird die behandelnde Ärztin oder der behandelnde Arzt unter anderem Kriterien wie Alter, Gesamtverfassung und bereits auftretende Begleiterkrankungen bei der Auswahl berücksichtigen. Sie/Er wird die aktuelle Lebenssituation des Betroffenen betrachten und dabei abwägen, welche Behandlung passend ist. Für eine erfolgreiche Therapie ist es unerlässlich, dass Patientinnen und Patienten sich bei Fragen vertrauensvoll an Ihren Arzt wenden und ihm mitteilen, welche Punkte Ihnen bei der Therapie wichtig sind.
Sie sind aktuell schlecht zu Fuß, weil Sie Knochenschmerzen plagen, und Sie möchten daher die Anzahl der Arzttermine möglichst geringhalten? Oder spielt eher die Aufenthaltsdauer in der Praxis /Klinik für Sie eine Rolle? Sprechen Sie die für Sie wichtigen Punkte an. Ihre Ärztin oder ihr Arzt wird Ihre Wünsche bei der Therapiewahl im Rahmen der Möglichkeiten berücksichtigen.
Therapieziele
Aktuell gilt das Multiple Myelom als eine unheilbare Erkrankung. Es wird jedoch im wissenschaftlichen Umfeld sehr intensiv diskutiert, ob eine Heilung nicht doch möglich wäre. Zum jetzigen Zeitpunkt wird das Multiple Myelom wie eine chronische, lebenslange Erkrankung betrachtet. Bei guter Behandlung in den entsprechenden Stadien kann man trotz der Diagnose weitestgehend normal leben. Die Forschung arbeitet ununterbrochen daran, einen Weg zu finden, die Erkrankung zu heilen.
Was bedeutet das für die Behandlung des Multiplen Myeloms?
Zunächst ist es Ziel, die bestmögliche Remissionsrate und längst mögliche Remissionsdauer zu erreichen. Remission, lat. für „Rückgang“, ist aktuell das höchste Therapieziel, welches mit der heutigen Medizin erreicht werden kann. Remission ist aber nicht mit Heilung gleichzusetzen!
Die International Myeloma Working Group16 hat international anerkannte Kriterien für das Ansprechen auf eine Behandlung festgelegt. Danach entscheidet sich welche Art der Remission vorliegt – d.h. wie weit der Knochenmarkkrebs zurückgedrängt wurde. Man unterscheidet zwischen:
- stringenter kompletter Remission21
- kompletter Remission
- sehr guter partieller Remission
- und partieller Remission
- und stabiler Erkrankung.
Ab wann eine komplette oder partielle Remission erreicht wird, ist durch die Kriterien der International Myelom Working Group16 genau festgelegt. Hierüber kann Sie Ihre Ärztin oder Ihr Arzt umfassend informieren.
Bei einer kompletten Remission sind keine Anzeichen der Erkrankung mehr nachweisbar. Es bestehen keine Symptome, und auch in den Laboruntersuchungen und in sonstigen Untersuchungen können keine Anzeichen auf das Bestehen der Erkrankung gefunden werden. Komplette Remission bedeutet ‚krankheitsfrei‘. Eine komplette Remission ist jedoch nicht gleichzusetzen mit einer Heilung. Bildhaft bedeutet die komplette Remission, dass sich die Erkrankung in einen tiefen Dornröschenschlaf zurückgezogen hat, jedoch wieder aufflackern kann. Einzelne Myelomzellen können somit noch vorhanden sein, auch wenn sie sich versteckt halten. Manche Patient:innen erreichen sogar eine sogenannte stringente komplette Remission.23 Dabei sind die Kriterien zum Nachweis versteckter Myelomzellen noch etwas strenger, das heißt, die Erkrankung hat sich noch etwas weiter zurückgezogen.
Unter minimaler Resterkrankung – kurz MRD – versteht man, dass nach einer Behandlung noch Myelomzellen im Knochenmark verbleiben.11 Sind jedoch keine Myelomzellen mehr nachweisbar, dann spricht man von MRD-Negativität. Der Unterschied bei der Bestimmung der MRD-Negativität gegenüber der Remission ist, dass Myelomzellen im Knochenmark und nicht im Blut nachgewiesen werden. Das heißt, es muss eine Knochenmarkpunktion durchgeführt werden. Das wird in der Praxis nicht regelmäßig gemacht, da es im Gegensatz zu einer Blutentnahme einen kleinen Eingriff bedeutet. Für die regelmäßigen Verlaufskontrollen reicht der Nachweis im Blut. Im Rahmen von klinischen Studien wird allerdings immer häufiger auch bestimmt, ob die Patient:innen mit einer Therapie eine MRD-Negativität, also ein besonders tiefes Ansprechen, erreichen können.
Partielle Remission ist eine Teilremission und bedeutet, dass die Krankheit nachweisbar ist, dies aber in einem geringeren Ausmaß als vor der Therapie. Das kann am Beispiel des Multiplen Myeloms bedeuten, dass die Patient:innen keine Symptome ihrer Erkrankung mehr verspüren, aber in Untersuchungen des Blutes, des Urins oder des Knochenmarks sich noch weiterhin veränderte Zellen oder sonstige Veränderungen nachweisen lassen. Diese sind nur noch gering ausgeprägt. Bildhaft kann man also von ‚krank, aber weniger stark‘ sprechen.
Wie eingangs erwähnt, wird das Myelom häufig erst in einem späteren Krankheitsverlauf entdeckt. Patient:innen verspüren bei Diagnosestellung oft schon Symptome, die als Anzeichen auf eine Verschlechterung des Allgemeinzustandes hinweisen. In dieser Phase können beispielsweise die Nieren oder Funktionen des Knochenmarks betroffen sein. Die Stabilisierung des aktuellen Krankheitszustandes dient im ersten Schritt der Sicherstellung des Erhalts der Körperfunktionen. Der Verschlechterung der Nierenfunktion, einer weiteren Erhöhung des Serumkalziumwertes oder auch Infektionen und Blutungen, soll damit entgegengewirkt werden.
Wenn sich Patient:innen in einem der späteren Stadien befinden, leiden Sie oft unter den Symptomen der Erkrankung. Diese können aus Müdigkeit, Infektanfälligkeit, Knochenschmerzen usw. bestehen. Mit einer gezielten Behandlung wird versucht, die Symptome zu lindern, sodass der Alltag nicht eingeschränkt werden muss.
Welche Rolle spielen welche Ärzte oder Ärztinnen?
Da das Multiple Myelom eine Krankheit mit vielen Facetten und Szenarien ist, werden Sie möglicherweise mit vielen verschiedenen Behandler:innen in Kontakt treten. Aus diesem Grund ist es wichtig zu wissen, welche verschiedenen Rollen dabei von Bedeutung sein können. Die wichtigsten Ansprechpartner:innen für die Behandlung werden dabei immer die Hämato-Onkolog:innen sein.

Wozu dient die Verlaufskontrolle?
Während der Behandlung wird in regelmäßigen Verlaufskontrollen immer wieder überprüft, wie sich die Werte Ihrer Erkrankung verhalten. Die regelmäßige Verlaufskontrolle umfasst körperliche Untersuchungen, Urinuntersuchungen, Blutabnahme mit Bestimmung der Myelom-Parameter, ggf. Bildgebung, ggf. Knochenmarkspunktion.
Die Verlaufskontrolle gibt Auskunft darüber, wie gut Ihre Erkrankung auf eine laufende Therapie anspricht. Wenn die Wirkung unzureichend ist, wird Ihre Ärztin oder Ihr Arzt die Therapie entsprechend anpassen. Die Verlaufskontrollen sind in der Remissionsphase wichtig, um rechtzeitig ein Rezidiv, das heißt einen Rückfall bzw. das Wiederauftreten der Erkrankung, zu erkennen. Sollte dies der Fall sein, kann frühzeitig mit einer weiteren Therapie begonnen werden. Aus diesem Grund ist es sehr wichtig, dass Sie regelmäßig Ihre Termine zur Verlaufskontrolle wahrnehmen, auch wenn Sie keine Beschwerden haben sollten.
Welche Therapieoptionen gibt es beim Multiplen Myelom?
Wie bereits erwähnt, hat sich in den letzten Jahren in der Therapielandschaft beim Multiplen Myelom einiges verändert. Es stehen inzwischen eine Vielzahl an Behandlungsmöglichkeiten zur Verfügung. Welche Therapie infrage kommt, hängt von einigen Faktoren ab. Zunächst muss entschieden werden, ob eine Therapie überhaupt angezeigt ist. In bestimmten Fällen, kann es sein, dass bisher nur eine Vorstufe des Multiplen Myeloms besteht oder der Knochenmarkkrebs asymptomatisch ist. Dann wird oft zunächst engmaschig kontrolliert, aber nicht direkt eine Behandlung eingeleitet. Mehr dazu erfahren Sie hier.
Liegt ein behandlungsbedürftiges Multiples Myelom vor, unterscheiden sich die Therapieoptionen je nachdem, ob die Patientin oder der Patient neu diagnostiziert wurde oder ein Rezidiv vorliegt. Patient:innen mit einem Rezidiv haben zuvor bereits mindestens eine Behandlung erhalten.
Bei neu diagnostizierten Patient:innen wird zunächst geprüft, ob sie für eine Stammzelltransplantation infrage kommen. Ist dies der Fall, wird sich in der Regel für eine Transplantation entschieden, da sie eine besonders gute Prognose bieten kann. Kommt eine Stammzelltransplantation nicht infrage stehen verschiedene moderne Substanzen bzw. Kombinationstherapien aus mehreren Substanzen zur Verfügung. Zu diesen gehören monoklonale Antikörper, Immunmodulatoren und Proteasom-Inhibitoren.
Bei Patient:innen, die bereits eine oder mehrere Behandlungen erhalten haben, richten sich die Therapieoptionen nach den vorherigen Behandlungen. Auch für diese Patient:innen kommen Kombinationen aus monoklonalen Antikörpern, Immunmodulatoren und/oder Proteasom-Inhibitoren infrage. Zusätzlich stehen für Patient:innen mit mehreren Vortherapien in den hinteren Therapielinien weitere Substanzklassen zur Verfügung: HDAC-Inhibitoren, Kernexport-Inhibitoren (SINE), Antikörper-Wirkstoff-Konjugate, Bispezifische Antikörper oder Zelltherapien.
In der Myelomtherapie ist es üblich, dass verschiedene Wirkstoffe bzw. Substanzklassen miteinander kombiniert werden, um besonders effektive Kombinationstherapien zu schaffen. Dabei werden bis zu vier verschiedene Medikamente miteinander kombiniert, um die Wirksamkeit zu steigern. Welche Kombinationen sich zur Therapie eignen ist individuell unterschiedlich. Fragen Sie bei Bedarf Ihre Ärztin oder Ihren Arzt.
Mehr zur Therapie beim Multiplen Myelom und dazu, wann welche Behandlungen zum Einsatz kommen können, erfahren Sie auch in der Patientenleitlinie der Europäischen Gesellschaft für Medizinische Onkologie (ESMO) und der European Hematology Association (EHA) (bisher nur auf Englisch erschienen).5
Was bedeutet eine Hochdosis-Chemotherapie mit anschließender Stammzelltransplantation?
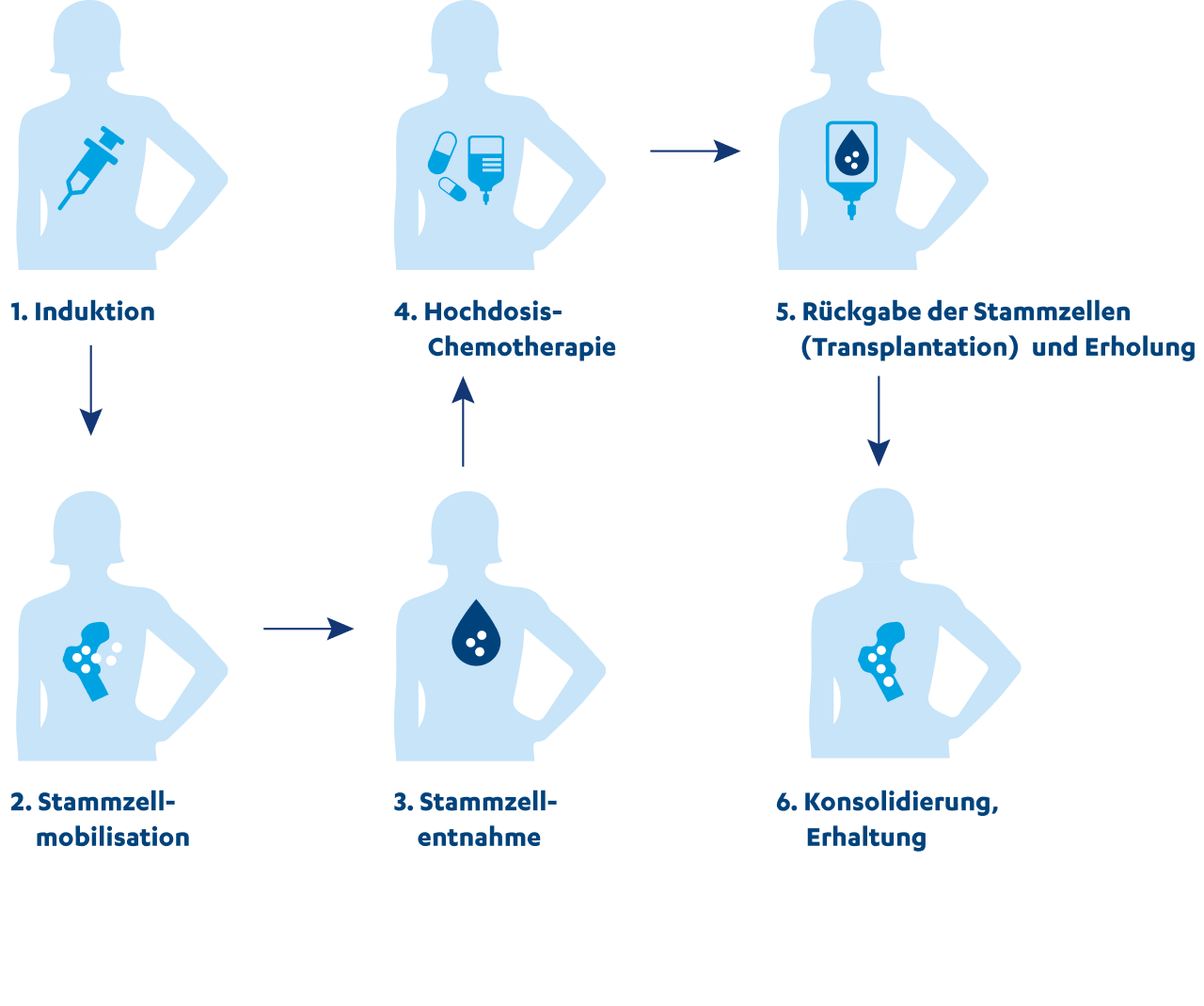
Die Hochdosis-Chemotherapie mit anschließender Stammzelltransplantation gilt derzeit als Standardmethode zur Behandlung des Multiplen Myeloms, sofern der Allgemeinzustand, das Alter der Patienten und der Patientenwunsch nicht dagegensprechen. Es handelt sich um eine autologe Stammzelltransplantation. Das bedeutet, dass die Stammzellen vom Patienten oder der Patientin selbst stammen. Sie werden entnommen und zur Aufbewahrung eingefroren. Dann erhalten die Patient:innen eine hochdosierte Chemotherapie, welche die Myelomzellen zerstört, aber auch das Knochenmark angreifen kann. Deshalb erhalten sie nach der Chemotherapie ihre Stammzellen zurück, die ins Knochenmark wandern und dort neue, gesunde Blutzellen bilden können. Diese Behandlung erfordert einen Krankenhausaufenthalt von 3–4 Wochen.
- Induktion: Durch eine Induktionstherapie sollen die Myelomzellen so gut es geht zurückgedrängt werden, ohne dass die Stammzellen zerstört werden.
- Stammzellmobilisation: Die Stammzellen werden durch Medikamente angeregt, vermehrt aus dem Knochenmark ins Blut auszuwandern.
- Stammzellentnahme: Anschließend wird dem:der Betroffenen Blut entnommen, die Stammzellen aus dem Blut herausgefiltert und für die Transplantation aufbereitet. Die Entnahme der Stammzellen erfolgt somit aus dem peripheren Blut und nicht direkt aus dem Knochenmark.
- Hochdosis-Chemotherapie: Die Hochdosis-Chemotherapie wird durchgeführt, um möglichst viele Myelomzellen des Patienten zu zerstören.
- Rückgabe der Stammzellen (Transplantation) und Erholung: Die entnommenen Stammzellen des Patienten werden ihm wieder verabreicht. Sie wandern zum Knochenmark und bilden dort neue, gesunde Blutzellen.
- Konsolidierung, Erhaltung: Eventuell ist noch eine Anti-Myelom-Therapie notwendig, um restliche Myelomzellen zu zerstören und so den Behandlungserfolg deutlich zu verbessern (= Konsolidierung). Später kann eine sogenannte Erhaltungstherapie erfolgen.
Allogene Stammzelltransplantation
die Stammzellen stammen von einem fremden Spender. Bei der allogenen Transplantation ist ein Graft-versus-Myeloma(GvM)-Effekt gewünscht, also dass das Immunsystem des Spenders die Krebszellen zerstört. Damit die Zellen vom eigenen Körper nicht abgestoßen werden, müssen die Gewebemerkmale des Spenders mit denen des Patienten weitgehend übereinstimmen. Geeignete Spender sind daher oftmals nahe Verwandte. Diese Art der Stammzelltransplantation kommt beim Multiplen Myelom normalerweise nicht zum Einsatz.
Periphere Blutstammzelltransplantation
die Stammzellen werden nach Stimulation aus dem Blut des Patienten oder des fremden Spenders entnommen und anschließend transplantiert.
Knochenmarktransplantation
die Stammzellen werden aus dem Knochenmark des Patienten oder vom fremden Spender entnommen und anschließend transplantiert.
Wie werden Therapien bei Knochenmarkkrebs verabreicht?
Viele Arzneimittel können einfach peroral, das heißt über den Mund, eingenommen werden, zum Beispiel in Form von Tabletten oder Kapseln. Das ist leider nicht bei allen Wirkstoffen möglich, denn die Wirkstoffe können zum Beispiel empfindlich auf Magensäure reagieren und schon im Magen unwirksam werden. Eine orale Anwendung ist in diesem Falle nutzlos. Dies kann ein Grund dafür sein, ein Medikament nicht als Tablette, sondern als Infusion oder als Injektion anzuwenden.
Wie verläuft eine intravenöse Therapie?
Oftmals werden Therapien in ein venöses Blutgefäß (intravenös; i.v.) als Infusion verabreicht, da der Wirkstoff auf diesem Wege zuverlässig in den Blutkreislauf gelangt oder auch nicht anders gegeben werden kann oder darf. Die Infusion wird in der Regel in der Praxis oder Krankenhausambulanz durchgeführt und kann mehrere Stunden in Anspruch nehmen. Die Dauer der Infusion ist abhängig von der Dosis und davon, wie Sie die Therapie vertragen.
- Informieren Sie sich genau über Zeit, Ort und geplante Dauer.
- Bringen Sie warme Kleidung mit.
- Denken Sie an Ihren Patientenausweis oder Ihre Infusionskarte.
- Sorgen Sie für Unterhaltungsmöglichkeiten (Musik, Bücher, Zeitschriften).
- Lassen Sie sich nach der Infusion abholen.
- Nehmen Sie sich danach Zeit zum Erholen.
Wie verläuft eine subkutane Therapie?
Mittlerweile können einige Wirkstoffe auch unter die Haut (subkutan; s.c.) als Injektion angewendet werden. Die Anwendung erfolgt deutlich schneller, innerhalb weniger Sekunden/Minuten, wodurch die Aufenthalte in Praxen oder Ambulanzen verkürzt werden können.
- Tragen Sie Ihre Injektionstermine in Ihrem Kalender ein.
- Denken Sie an Ihren Patientenausweis oder Ihre Injektionskarte.
- Ziehen Sie lockere Kleidung an.
- Vermeiden Sie Druck auf die Injektionsstelle.
Wie verläuft eine orale Therapie?
Oftmals werden Therapien in ein venöses Blutgefäß (intravenös; i.v.) als Infusion verabreicht, da der Wirkstoff auf diesem Wege zuverlässig in den Blutkreislauf gelangt oder auch nicht anders gegeben werden kann oder darf. Die Infusion wird in der Regel in der Praxis oder Krankenhausambulanz durchgeführt und kann mehrere Stunden in Anspruch nehmen. Die Dauer der Infusion ist abhängig von der Dosis und davon, wie Sie die Therapie vertragen.
- Nehmen Sie Ihre Tabletten / Kapseln immer genau nach Absprache mit Ihrer Ärztin oder Ihrem Arzt ein.
- Wenn es Ihnen im Alltag schwerfällt, an die Einnahme zu denken, gibt es viele Unterstützungsmöglichkeiten (Medikamentenplan, Erinnerungsnotizen, Apps, Patient:innen-Unterstützungs-programme). Sprechen Sie dazu Ihre Ärztin oder Ihren Arzt an.
Wie kann man die Behandlung bei Knochenmarkkrebs unterstützen?
Unterstützung der Therapie
Vor der Therapie mit Bisphosphonaten sollten Sie unbedingt den Zahnarzt aufsuchen. Denn bei einer längeren Therapie mit Bisphosphonaten besteht bei Eingriffen im Mund-Kieferbereich das Risiko, dass Wunden nicht richtig abheilen und der Kieferknochen beschädigt wird. Während der Therapie sollten regelmäßige Kontrollen bei Zahnärzt:innen erfolgen und diese über die laufendende Behandlung informiert werden. Dadurch kann das Risiko möglichst geringgehalten werden.6,8
Komplementäre Behandlungsmethoden beim Multiplen Myelom
Ergänzend zur onkologischen Therapie haben viele Patient:innen das Interesse, komplementäre Therapiemethoden anzuwenden. Diese Behandlungsmethoden sollten nach aktuellem Stand der Schulmedizin nur ergänzend angewendet werden, mit dem Ziel, die unangenehmen Begleiterscheinungen der Erkrankung oder der Therapie zu mildern. Besteht bei Ihnen Interesse an einem solchen Angebot, sollten Sie die alternativen Behandlungen ausschließlich zusätzlich (komplementär) und immer in Abstimmung mit Ihrer betreuenden Ärztin oder ihrem betreuenden Arzt anwenden. Diese:r kann beurteilen, ob komplementäre Therapien Einfluss auf die Wirksamkeit bestehender Therapien haben oder unerwünschte Wechselwirkungen hervorrufen können.
Sprechen Sie bei Interesse bitte unbedingt mit Ihrer Ärztin oder ihrem Arzt darüber und teilen Sie mit, wenn Sie homöopathische Mittel oder komplementäre Methoden anwenden möchten. Auch die kleinsten Maßnahmen können Auswirkungen auf Ihre laufende Behandlung haben.
Unterstützende Therapie mit Bisphosphonaten
Zusätzlich können Sie im Rahmen Ihrer Myelom-Therapie weitere Medikamente zur Unterstützung erhalten, die gegen bestimmte Symptome und Komplikationen des Multiplen Myeloms und der Wirkstoffe wirksam sind. Eine zusätzlich unterstützende Therapie wird auch supportive Therapie genannt.
Bei Knochenbeteiligung (bei ca. 80–95 % der Patient:innen) gehören Bisphosphonate zur Standardtherapie, da sie den knochenzerstörenden Prozess aufhalten. Behandelte Patient:innen erfahren dadurch oft eine deutliche Reduzierung ihrer Knochenschmerzen. Bisphosphonate können dabei entweder oral als Tablette/Kapsel oder als Infusion angewendet werden.32 Sie sind relativ sichere Medikamente, können allerdings grippeähnliche Symptome als Nebenwirkung hervorrufen. Bisphosphonate können Nierenprobleme verursachen.6,18 Bei Myelom-Patienten sollten Bisphosphonaten über zwei Jahre verabreicht werden und danach eine Fortsetzung individuell von der Ärztin oder dem Arzt evaluiert werden, wobei die Nierenfunktion regelmäßig überwacht werden soll.1,5
Welche Nebenwirkungen kann eine Myelomtherapie haben?
Zu den Wirkungen eines Medikamentes gehören ggf. auch unerwünschte Ereignisse. Sie werden Nebenwirkungen genannt und können auftreten, müssen aber nicht. Oft sind Nebenwirkungen nur mild oder bleiben unbemerkt. Manchmal können die Nebenwirkungen jedoch auch schwerwiegend werden. Dies variiert von Patient:in zu Patient:in und kann etwa mit Faktoren wie Alter, Gesundheitszustand, Gewicht oder Ernährung zusammenhängen.
Entscheidend ist, dass nur die Arzneimittel zugelassen werden, deren Nutzen das Risiko von Nebenwirkungen überwiegt. Und zum Glück treten die meisten Nebenwirkungen nur bei wenigen Patient:innen auf. Ihre Ärztin oder Ihr Arzt wird anhand ihr/ihm vorliegender Daten die beste Therapieoption für Sie finden, die Therapie überwachen und gegebenenfalls zum Beispiel die Dosierung anpassen. Sollten im Rahmen Ihrer Therapie Nebenwirkungen auftreten, setzen Sie auf keinen Fall selbstständig das Medikament ab oder verringern die Dosis. Informieren Sie möglichst schnell Ihre behandelnde Ärztin oder Ihren behandelnden Arzt und besprechen Sie weitere Schritte. Die möglichen Nebenwirkungen im Rahmen der Myelomtherapie sind so vielfältig wie die möglichen Therapieoptionen. Bei Fragen wenden Sie sich immer zeitnah an Ihre Ärztin oder Ihren Arzt.
Wie verlaufen Rehabilitation und Nachsorge beim Multiplen Myelom?
Knochenmarkkrebs und die Therapie bedeuten ein hohes Maß an Belastung für die Betroffenen. Zudem können belastende Symptome und möglicherweise Nebenwirkungen auftreten. Um Krankheits- und Therapiefolgen vorzubeugen, besteht die Möglichkeit Rehabilitationsmaßnahmen wahrzunehmen. Eine solche „Reha“ kann sich zum Beispiel an die Erstlinienbehandlung anschließen. Da das Multiple Myleom nicht heilbar ist und die Wahrscheinlichkeit besteht, dass die Erkrankung wiederkehrt, ist der richtige Zeitpunkt allerdings nicht so einfach zu bestimmen. Am besten besprechen Sie die Möglichkeiten für eine Reha mit Ihrer behandelnden Ärztin oder Ihrem behandelnden Arzt.
Mehr zu Reha-Maßnahmen und welche Leistungen die Krankenkassen übernehmen, können Sie hier nachlesen.
Auch die Rückkehr in ein aktives Sozialleben und gegebenenfalls den Beruf, ist Teil der Rehabilitation.
Hier finden Sie deshalb wissenswertes rund um das Thema Krebs und Beruf.
Neben einer meist einmaligen Reha, ist auch eine regelmäßige Nachsorge wichtig. Dabei wird die Aktivität der Erkrankung überprüft, um einen möglichen Rückfall der Erkrankung rechtzeitig zu entdecken. Am Ende einer Therapie bei stabiler Erkrankung findet die Nachsorge meist im Abstand von 3–6 Monaten statt.33 Da das Multiple Myelom nicht heilbar ist, erfolgt die Nachsorge in der Regel ein Leben lang. Die Abstände können sich jedoch verändern.
Umgang mit dem Tod
Wie geht man beim Multiplen Myelom mit dem Sterben um?
Die moderne Medizin entwickelt sich stets weiter, um die Lebensqualität von Krebspatient:innen und ihren Angehörigen zu verbessern. Betroffene sollen die letzte Phase ihres Lebens lebenswert und individuell gestalten, insbesondere aber auch einen würdevollen Umgang mit dem Lebensende führen können.
Multiples Myelom: Forschung und News
Alle neuen Therapien müssen vor ihrer Zulassung in klinischen Studien ausführlich auf Wirksamkeit und Verträglichkeit untersucht werden. Das gilt auch für Krebstherapien. Bevor jedoch eine Therapie einem Patient:innen verabreicht werden darf, muss diese vorab mehrere Untersuchungen durchlaufen, um die Wirksamkeit und Unbedenklichkeit der neuen Substanzen sicherzustellen. Dies geschieht über Laborversuche in Zellkulturen, Krankheitsmodelle am Computer und / oder Tierversuche. Erst wenn alle diese Untersuchungen erfolgreich waren, darf das Medikament im nächsten Schritt an Menschen auf seine Wirkung hin untersucht werden.

Die neuen Arzneimittel und Behandlungsverfahren werden an einer größeren Anzahl von Patient:innen in ausgewählten medizinischen Zentren untersucht und in der Regel mit bereits verfügbaren Therapien verglichen. Um eine klinische Studie durchzuführen, benötigen die Einrichtungen Patient:innen, die sich bereiterklären, bei einer klinischen Studie mitzuwirken. Mithilfe der ausgewählten Patient:innen kann in einer Studie die Verträglichkeit und Wirksamkeit untersucht werden. Vorher festgelegte Kriterien wie Lebensqualität oder das Fortschreiten der Erkrankung werden für die neue und die herkömmliche Therapie gegenübergestellt und der Effekt genau dokumentiert. Der Ablauf ist dabei klar festgelegt und die Teilnahme daran ist freiwillig. Außerdem ist sie an bestimmte weitere Kriterien geknüpft. Beispielsweise wird jede klinische Studie vor Beginn abhängig vom zu untersuchenden Arzneimittel entweder vom Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) oder dem Paul-Ehrlich-Institut (PEI) genauestens unter die Lupe genommen. Dabei wird strengstens geprüft, welche Verfahren bei der Studie angewendet werden, inwieweit die theoretischen Modelle plausibel sind und der Reduktion von Nebenwirkungen dienen. Weiterhin wird die Studie von einer unabhängigen Ethikkommission begutachtet, um sicherzustellen, dass das geplante Vorgehen ethisch korrekt ist. Erst wenn die Studie behördlich genehmigt wurde und ein positives Votum der Ethikkommission vorliegt, darf mit der Studie begonnen werden.
Ob die Teilnahme an einer Studie sinnvoll ist, muss jeder individuell zusammen mit seiner Ärztin bzw. seinem Arzt und ggf. Angehörigen entscheiden. Eine ausführliche Beratung mit der behandelnden Ärztin oder dem behandelnden Arzt, bei der alle Vor- und Nachteile abgewogen werden können, ist deshalb unabdingbar. Die Teilnehmer:innen an klinischen Studien tragen zur Entwicklung neuer Arzneimittel und zur Verbesserung von Behandlungsoptionen bei. Selbst dann, wenn sie persönlich nicht auf eine neue Behandlungsmethode oder ein neues Arzneimittel ansprechen sollten. Häufig ist die Teilnahme an einer klinischen Studie auch eine Chance Zugang zu neuen Therapien zu erhalten, wenn alle zugelassen Therapieformen ausgeschöpft sind.
Mehr zu klinischen Studien sowie deren Vorteilen und Risiken erfahren Sie hier.
Bei Interesse an der Teilnahme an klinischen Studien, ist Ihre Ärztin oder Ihr Arzt die/der erste Ansprechpartner:in. Ärzt:innen können bewerten, ob und welche klinischen Studien infrage kommen. Weiterhin können Selbsthilfeorganisationen unterstützen, medizinische Zentren zu finden. Eine gute und in der Regel aktuelle Übersicht stellt die Patientenorganisation AMM online zur Verfügung.
Das könnte Sie auch interessieren

In den Folgen 2, 3 & 8 unseres Podcast „Mein Krebsratgeber zum Hören“ sprechen die Betroffenen Thomas und Jasmin, gemeinsam mit der Psychoonkologin Dr. Daniela Meger-David, über die Herausforderungen die mit der Diagnose Knochenmarkkrebs einhergehen.
Mit umfassenden Informationen und Tipps zum Multiplen Myelom bietet das Buch viel Unterstützung durch vielfältige Checklisten und Platz für persönliche Notizen, die Ihnen die Gelegenheit bieten, Ihre Lebenssituation zu reflektieren und Ihre Gesundheit aktiv mitzugestalten.

Sie sind an Krebs erkrankt oder stehen einer betroffenen Person nahe? Dabei haben Sie Fragen rund um die Erkrankung, die nach dem ärztlichen Gespräch offengeblieben sind und auch auf diesen Seiten nicht beantwortet werden? Hier können Sie Ihre Fragen einfach und anonym stellen und erhalten fachlich fundierte Antworten in wenigen Tagen.
Links und Downloads
Hier finden Sie Broschüren und Informationsmaterial für Betroffene und Angehörige.
Referenzen
- Wörmann B et al. Onkopedia-Leitlinie Multiples Myelom, Stand Mai 2018, unter: https://www.onkopedia.com/de/onkopedia/guidelines/multiples-myelom/@@guideline/html/index.html. Letzter Zugriff am 20.07.2023.
- Deutsches Krebsforschungszentrum. Multiples Myonom. Symptome bei Multiplem Myelom: Warnzeichen erkennen, unter: https://www.krebsinformationsdienst.de/tumorarten/mulitples-myelom/symptome.php. Letzter Zugriff am 20.07.2023.
- Myelom.Online e. V. Diagnose, unter: https://myelom.online/das-multiple-myelom/diagnose. Letzter Zugriff am 20.07.2023.
- Pharma Fakten e.V. Multiples Myelom: Auf der Suche nach Heilung, unter: https://pharma-fakten.de/grafiken/584-multiples-myelom-auf-der-suche-nach-heilung/. Letzter Zugriff am 20.07.2023.
- European Society for Medical Oncology - ESMO. Multiples Myelom: Ein Ratgeber für Patientinnen und Patienten, unter: https://www.esmo.org/content/download/138233/2546609/file/DE-Multiples-Myelom-Patientenleitlinie.pdf. Letzter Zugriff am 20.07.2023.
- Deutsche Krebshilfe. Die blauen Ratgeber. Plasmozytom Multiples Myelom, unter: https://www.krebshilfe.de/infomaterial/Blaue_Ratgeber/Plasmozytom-Multiples-Myelom_BlaueRatgeber_DeutscheKrebshilfe.pdf. Letzter Zugriff am 20.07.2023.
- Krebsliga Schweiz Multiples Myelom (Plasmazellmyelom), unter: https://www.krebsliga.ch/ueber-krebs/krebsarten/multiples-myelom-plasmazellmyelom. Letzter Zugriff am 20.07.2023.
- Deutsche Krebsgesellschaft. ONKO Internetportal. Therapie und Nachsorge des Multiplen Myeloms, unter: https://www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/krebsarten/multiples-myelom-plasmozytom-morbus-kahler/therapie.html. Letzter Zugriff am 20.07.2023
- Gesellschaft der epidemiologischen Krebsregister e.V. (GEKID), Zentrums für Krebsregisterdaten (ZfKD) im Robert Koch-Institut. Krebs in Deutschland für 2017/2018: Multiples Myelom, unter: https://www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebs_in_Deutschland/kid_2021/kid_2021_c90_multiples_myelom.pdf?__blob=publicationFile. Letzter Zugriff am 20.07.2023.
- Bundesministeriums für Gesundheit. gesund.bund.de. Multiples Myelom, unter: https://gesund.bund.de/multiples-myelom. Letzter Zugriff am 20.07.2023.
- Sektion Multiples Myelom, Medizinische Klinik V, Universitätsklinikum Heidelberg und Nationales Centrum für Tumorerkrankungen Heidelberg (NCT). Patienten-Handbuch Multiples Myelom 2022, unter: https://www.klinikum.uni-heidelberg.de/fileadmin/medizinische_klinik/Abteilung_5/docs/Veranstaltungen/MM_Tage_Patientenhandbuch/Patientenhandbuch_MM__2022.pdf. Letzter Zugriff am 20.07.2023.
- Deutsche Leukämie- & Lymphom-Hilfe e.V. Patientenfibel Multiples Myelom Diagnostik und Begriffserläuterungen, unter: https://www.leukaemie-hilfe.de/fileadmin/user_upload/dlh-broschueren/DLH_Verein_Patientenfibel_2022.pdf. Letzter Zugriff am 20.07.2023.
- Kompetenznetz Maligne Lymphome. Symptome, unter: https://lymphome.de/multiples-myelom/symptome/ Letzter Zugriff am 20.07.2023.
- Deutsche Leukämie- & Lymphom-Hilfe e.V. Die Bestimmung der Freien Leichtketten im Blut: Klinische Bedeutung beim Multiplen Myelom (Plasmozytom) und anderen Monoklonalen Gammopathien, unter: https://www.leukaemie-hilfe.de/fileadmin/user_upload/dlh-info-blaetter/dlh_infoblatt_leichtketten.pdf. Letzter Zugriff am 20.07.2023
- Durie BG, Salmon SE. A clinical staging system for multiple myeloma. Correlation of measured myeloma cell mass with presenting clinical features, response to treatment, and survival. Cancer. 1975;36(3):842–54.
- International Myoloma Foundation. International Myeloma Working Group, unter: https://www.myeloma.org/international-myeloma-working-group. Letzter Zugriff am 20.07.2023.
- Palumbo A et al. Revised International Staging System for Multiple Myeloma: A Report From International Myeloma Working Group. J Clin Oncol. 2015;33(26):2863–9.
- Sektion Multiples Myelom, Medizinische Klinik V, Universitätsklinikum Heidelberg und Nationales Centrum für Tumorerkrankungen Heidelberg (NCT). Patienten-Handbuch Multiples Myelom 2020, unter: https://www.myelom.org/component/jdownloads/?task=download.send&id=389&catid=37&m=0&Itemid=101.Letzter Zugriff am 20.07.2023.
- Myelom.Online e. V. Vorstufen des multiplen Myeloms, unter: https://myelom.online/das-multiple-myelom/multiples-myelom-vorstufen. Letzter Zugriff am 20.07.2023.
- Scheid C et al. Onkopedia-Leitlinie Monoklonale Gammopathie unklarer Signifikanz (MGUS). Stand Juli 2021, unter: https://www.onkopedia.com/de/onkopedia/guidelines/monoklonale-gammopathie-unklarer-signifikanz-mgus/@@guideline/html/index.html. Letzter Zugriff am 20.07.2023.
- Myelom.Online e. V. Vorstufen des multiplen Myeloms, unter: https://myelom.online/images/pdf-dokumente/pdf-Dokumente/patientenhandbuch-2022.pdf. Letzter Zugriff am 20.07.2023.
- Pharma Fakten e.V., Experte Prof. Dr. Einsele: Europa hinkt bei Krebsforschung hinterher, 03.06.2019, unter: https://pharma-fakten.de/news/778-experte-prof-dr-einsele-europa-hinkt-bei-krebsforschung-hinterher/. Letzter Zugriff am 20.07.2023.
- Myelom.Online e. V. Alles zur Therapie, unter: https://myelom.online/multiples-myelom-informationsmaterial/therapie/therapiekriterien. Letzter Zugriff am 20.07.2023.
- Myelom.Online e. V. Monoklonale Antikörper, unter: https://myelom.online/multiples-myelom-medikamente/monoklonale-antik%C3%B6rper. Letzter Zugriff am 20.07.2023.
- Myelom.Online e. V. Immunmodulatoren, unter: https://myelom.online/multiples-myelom-medikamente/immunmodulatoren. Letzter Zugriff am 20.07.2023.
- Myelom.Online e. V. u Proteasom-Inhibitoren, unter: https://myelom.online/multiples-myelom-medikamente/proteasom-inhibitoren. Letzter Zugriff am 20.07.2023.
- Myelom.Online e. V. Bispezifischer Antikörper, unter: https://myelom.online/multiples-myelom-medikamente/bispezifische-antik%C3%B6rper. Letzter Zugriff am 20.07.2023.
- Myelom.Online e. V. HDAC-Inhibitoren, unter: https://myelom.online/multiples-myelom-medikamente/hdac-inhibitoren. Letzter Zugriff am 20.07.2023.
- Myelom.Online e. V. XPO1-Inhibitoren, unter: https://myelom.online/multiples-myelom-medikamente/xpo1-inhibitoren. Letzter Zugriff am 20.07.2023.
- Myelom.Online e. V. Antikörper-Wirkstoff-Konjugate, unter: https://myelom.online/multiples-myelom-medikamente/antikoerper-wirkstoff-konjugate. Letzter Zugriff am 20.07.2023.
- Myelom.Online e. V. CAR-T-Zell-Therapie, unter: https://myelom.online/multiples-myelom-medikamente/car-t-zell-therapie. Letzter Zugriff am 20.07.2023.
- Deutsche Leukämie- & Lymphom-Hilfe e.V. Bisphosphonate beim Multiplen Myelom, unter: https://www.leukaemie-hilfe.de/fileadmin/user_upload/dlh-info-blaetter/dlh_infoblatt_bisphosphonate-beim-mm.pdf. Letzter Zugriff am 20.07.2023.
- Leitlinienprogramm Onkologie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF), Deutschen Krebsgesellschaft e. V. (DKG) und der Stiftung Deutsche Krebshilfe (DKH). S3-Leitlinie Diagnostik, Therapie und Nachsorge für Patienten mit monoklonaler Gammopathie unklarer Signifikanz (MGUS) oder Multiplem Myelom Kurzversion 1.0 - Februar 2022, unter: https://register.awmf.org/assets/guidelines/018-035OLk_S3_Diagnostik-Therapie-Nachsorge-monoklonaler-Gammopathie-unklarer-Signifikanz-MGUS-Multiplem-Myelom_2022-02.pdf. Letzter Zugriff am 20.07.2023.
Dieser Text entspricht den redaktionellen Standards der JanssenWithMe und wurde von einem Mitglied des redaktionellen Beirats der JanssenWithMe geprüft. Lernen Sie hier den medizinischen Beirat unserer Redaktion kennen.
EM-150081


